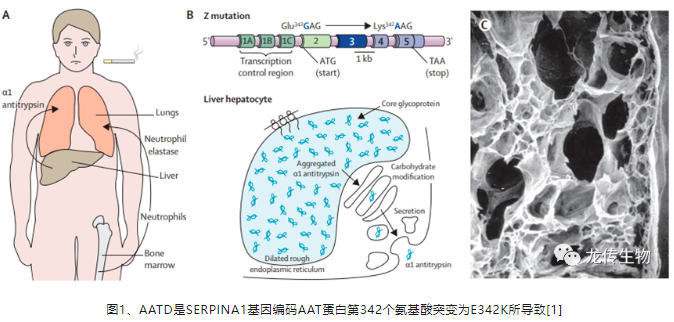
α‑1抗胰蛋白酶(AAT)是人类基因组Pi基因座SERPINA1基因编码丝氨酸蛋白酶抑制蛋白(serpin)超家族的蛋白酶抑制剂,正常AAT蛋白主要由肝细胞合成并分泌至血液中的循环糖蛋白,通过抑制嗜中性粒细胞蛋白酶(neutrophil protease),抵抗感染以保护肝和肺等脏器,免于在炎性阶段遭受非特异性损伤。
α-1抗胰蛋白酶缺乏症(alpha-1 antitrypsin deficiency,AATD)是一种遗传性罕见病,SERPINA1基因编码AAT蛋白第342个氨基酸的密码子由GAG突变为AAG,由谷氨酸(Glutamic acid,Glu,E)转变为赖氨酸(Lysine,Lys,K)发生了PiZ突变[1](图1)。
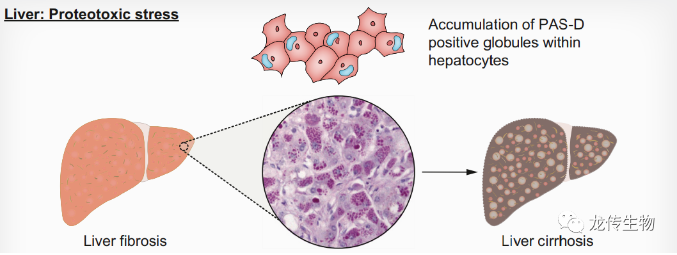
AAT的错误折叠和聚合会产生蛋白毒性应激(proteotoxic stress),从而促进肝硬化和肝肿瘤的发展。AAT蛋白错误折叠轻微程度者会导致滞留在肝细胞的内质网(ER),严重程度者在肝细胞中积聚形成聚合物小球(globule),此有毒的肝脏聚合物可通过糖原D-PAS高碘酸希夫(英文文献或称PAS-D)染色鉴定[2](图2)。
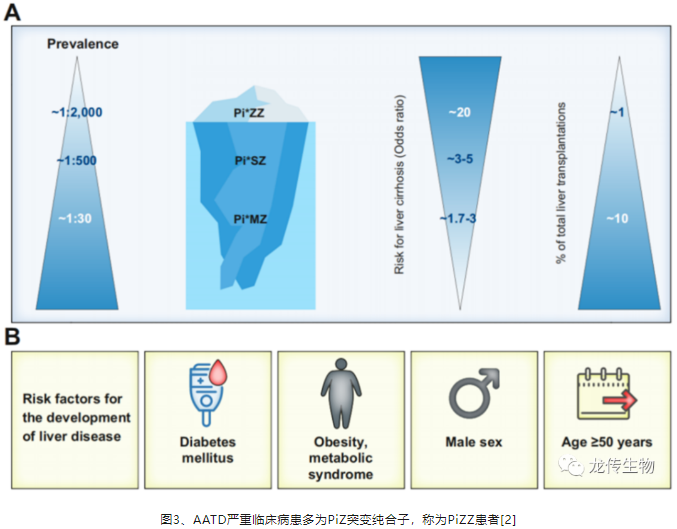
PiZ突变最终导致肝纤维化、肝硬化和肝癌,约95% 的严重临床病例为PiZ突变纯合子,称为PiZZ患者[1-3]。AATD不仅影响成人,PiZZ婴儿出现新生儿黄疸和胆汁淤积,其中一部分进展为晚期纤维化或肝硬化,需要肝移植。我国临床也较少考虑AATD基因诊断,即便在美国仅约10%的 PiZZ 肝患者被诊断出来,在低估AATD罕见病的情况之下,美国和欧洲的PiZZ频率分别约为1/2000和1/2500[2] (图3)。我国的人口基数大,可能存在许多PiZZ 肝患者未被诊断。
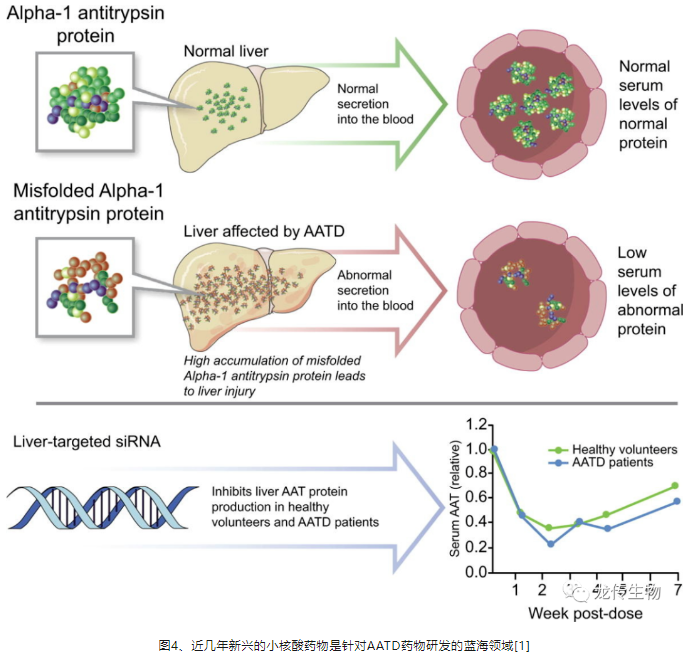
二、近几年新兴的小核酸药物是针对AATD药物研发的蓝海领域
目前针对AATD的已上市药物均为血液制品,是通过静脉输注血浆补充正常AAT的酶替代疗法,且主要治疗AATD引起的肺气肿而非治疗AATD肝病,AATD肝病患者除了肝移植以外,目前没有其他药物治疗的选择。故此,近几年新兴的小核酸药物是针对AATD药物研发的蓝海领域[1](图4),进展最快的是美国Arrowhead公司的Fazirsiran siRNA小核酸药物[4],也才正进入3期临床的阶段。然而,我国此AATD管线布局极少,其中一个原因是缺乏自主研发、经济且可取得的AATD动物模型。
三、现有的免疫健全小鼠背景的人源化PiZZ小鼠模型
美国佛罗里达大学研发的AATD疾病C57BL/6J 小鼠模型,经历基因型鉴定与筛选获得的纯合子PiZZ小鼠,得至3月龄以上才呈现D-PAS染色肝组织病理检查阳性等肝脏病理生理学特征[5]。
利用小鼠尾静脉高速流体力学注射,巧妙地结合点突变人源基因的裸质粒,能通过快速将大量液体注入血管中产生的动态压力的物理力来透化细胞膜并促进细胞内基因转移。美国匹兹堡大学通过裸质粒pCMV-hAAT导入正常人源AAT基因到小鼠体内表达,小鼠血清长达6个月都可以稳定表达hAAT蛋白[6]。
四、龙传生物实时可视性肝脏人源化PiZZ小鼠模型具有明确的指标
1、实时可视性Luc2讯号
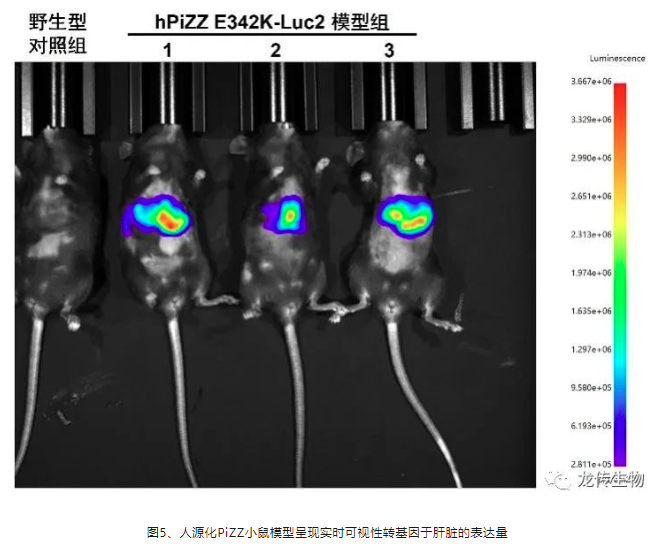
龙传生物实时可视性肝脏人源化PiZZ小鼠模型能表达Firefly Luciferase luc2基因(Luc2),在造模之初到实验终点全流程,体重为20g的小鼠,每只腹腔注射200 μl 的D-Luciferin溶液,通过小动物活体成像仪侦测Luc2讯号,能实现转基因的实时可视性,以及转基因在小鼠肝脏人源化的程度(图5)。
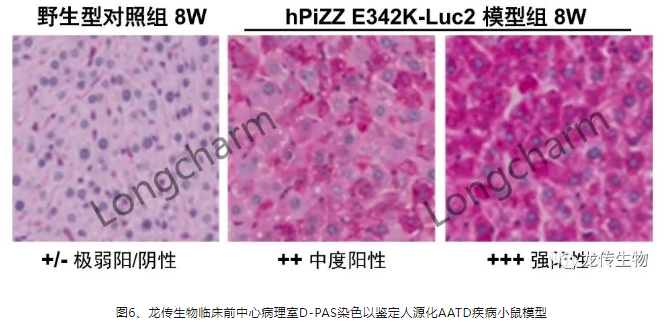
2、 肝组织的D-PAS染色呈强阳性:AAT发生错误折叠在肝脏形成聚合物
龙传生物以人SERPINA1基因(Genebank ID:NM_000295.5)为参考序列,设计第342个氨基酸自谷氨酸(Glutamic acid,Glu,E)突变为赖氨酸(Lysine,Lys,K),相应核苷酸序列GAG定点突变为AAG。故此,龙传生物实时可视性肝脏人源化PiZZ小鼠模型能表达最重度纯合子AATD患者的PiZZ E342K基因,于8W取一小片位置具有可比性的肝脏组织固定,在龙传生物自建的病理室进行D-PAS染色以鉴定AATD肝细胞质内异常折叠的聚合物小球、淀粉样蛋白等。根据颜色深浅来区分阳性反应程度,极强阳性:++++,强阳性:+++,中度阳性:++,弱阳:+,极弱阳/阴性:+/-。如图6所示,短期八周即可实现AATD病理特征,D-PAS染色肝组织病理检查聚合物小球阳性,揭示错误折叠蛋白的聚集程度。
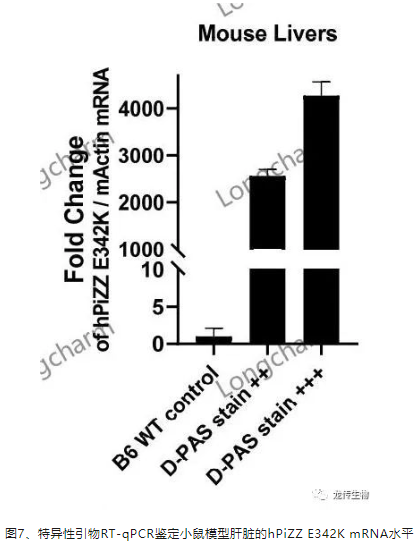
3、特异性引物RT-qPCR鉴定小鼠模型肝脏的hPiZZ E342K mRNA水平
龙传生物实时可视性肝脏人源化PiZZ小鼠模型8W肝组织D-PAS染色法呈阳性的小鼠模型,其肝脏组织匀浆后,以Trizol法提取总RNA,反转录成1st-cDNA后,以hPiZZ E342K特异性引物鉴定mRNA水平(与鼠源Actin相对定量)。结果表明,人源化PiZZ小鼠模型于8W不但有近似临床AATD的病理特征,其病理严重程度与人源PiZZ E342K mRNA水平呈正相关(图7)。
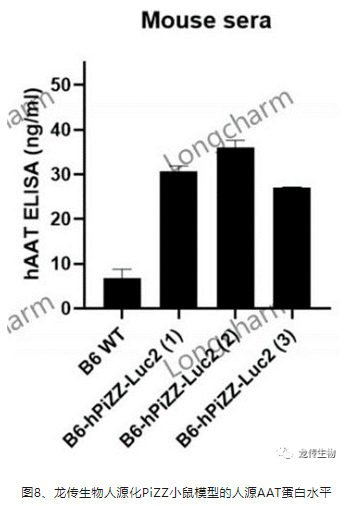
4、ELISA鉴定小鼠模型肝脏的人源AAT蛋白水平
龙传生物实时可视性肝脏人源化PiZZ小鼠模型Luc2讯号平均值为1.11E + 06,荧光信号相近的3只小鼠血清用人源特异性ELISA检测hAAT 水平,小鼠血清中hAAT浓度约为30 ng/ml,Luc2讯号能反映人源AAT的蛋白水平(图8)。
综上,龙传生物实时可视性肝脏人源化PiZZ小鼠模型已具有4个明确的指标(小动物活体成像Luc2讯号、血清hAAT水平、hPiZZ E342K水平和 D-PAS染色),在接受甲方委托进行药效评价服务时,能做最优的质控,以及较全面的数据反馈(图9)。

五、龙传生物实时可视性肝脏人源化PiZZ小鼠模型的应用场景
1、适用于靶向人SERPINA1基因的siRNA小核酸药物研发
RNAi 疗法沉默肝脏的AAT mRNA,减少AAT的错误折叠,有益于AATD 相关肝病患者的治疗[1],美国Arrowhead公司的靶向人源 SERPINA1基因用以治疗AATD的siRNA小核酸药物Fazirsiran,正在进行临床三期试验,根据该公司专利CN114222820A[4]显示在非人灵长类NHP模型药效最佳的AD04837,其正义链未修饰靶序列为5’-AGCGUUUAGGCAUGUUUAACA-3’,反义链未修饰靶序列为5’-UGUUAAACAUGCCUAAACGCU-3’,靶向人源 SERPINA1基因的编码区(CDS)的第2个外显子。龙传生物实时可视性肝脏人源化PiZZ小鼠模型涵盖此靶点,合适siRNA小核酸药物原研药物在临床前药效评价时可以使用Arrowhead公司Fazirsiran为阳参药。
已上市的siRNA小核酸药物有数个是靶向致病基因的3’-UTR,故此龙传生物研发了另一个人源化PiZZ小鼠模型,包含人源 SERPINA1 E342K 基因的CDS和3’-UTR,但不包含Luc2报导基因,故此活体小鼠可通过ELISA检测人源AAT蛋白进行质控,为相关靶向人SERPINA1基因3’UTR的小核酸药物研发企业提供临床前药效评价研究。
2、适用于靶向人SERPINA1基因的寡核苷酸药物研发
(1) ASO
反义技术平台通过反义寡核苷酸(antisense oligonucleotide,ASO)与其互补 靶标RNA杂交,触发RNase H切割靶标。靶向人类AAT的ASO,显著治疗PiZ小鼠的AATD肝病,减少了该小鼠模型中的肝纤维化,ASO是治疗AATD肝病有前途的药物之一[7]。
(2) RNA编辑疗法
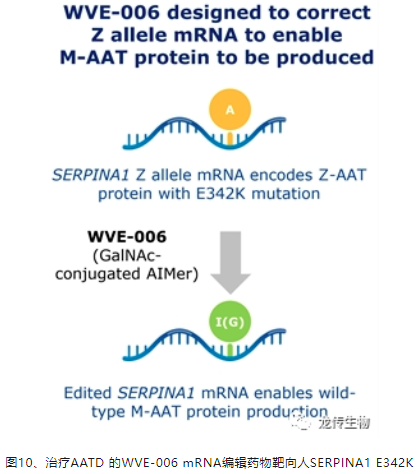
2023年12月Wave Life Sciences公司基于AIMer 平台开发的RNA编辑疗法WVE-006药物进入临床一期,是属于GalNAc偶联的RNA编辑寡核苷酸,进入胞内后,招募内源性的ADAR酶(包括广泛和组成性表达的ADAR1 p110亚型)进行人SERPINA1特异性的A-to-G mRNA编辑[8],旨在提高功能性、正常AAT蛋白的水平,同时减少异常折叠的AAT蛋白的存在,从而治疗AATD相关的肝病和肺病。
3、适用于治疗AATD的小分子药物研发
2020年和2021年,Vertex公司两个促进蛋白正确折叠的小分子药物VX-814和VX-864作为AAT调节剂[9-10],相继因为安全性和疗效不佳而终止。继而Centessa / Z Factor公司治疗AATD一系列小分子药物中[11],ZF-874用以调节正常AAT蛋白功能,在临床前试验中,能恢复PiZ小鼠模型的正常AAT超过28天,然而2021年11月在临床试验中其3名受试者中1名出现了延迟、可逆的ALT和AST升高而终止,小分子药物应用于AATD治疗暂时受阻。
此类基于促进 AAT 蛋白正确折叠或是抑制错误折叠的 AAT 蛋白,用以治疗AATD的小分子药物,也可使用龙传生物的实时可视性肝脏人源化PiZZ小鼠模型进行药效评价。
龙传生物的临床前中心药理药效研究平台,正开发更多的动物模型,并提供整体的体内与体外实验服务,欢迎上官网(http://www.longcharmbio.com/serviceitems/info_itemid_3.html)或来电谘询。


